日前,广州泰和肿瘤医院顺利完成国家医疗器械临床试验机构的备案。在国家的医疗器械临床试验机构备案管理信息系统完成了备案 (备案号: 械临机构备 202100084),就标志着我院具备了开展相关医疗器械临床试验的资质,同时也标志着我院科教工作再上新台阶。
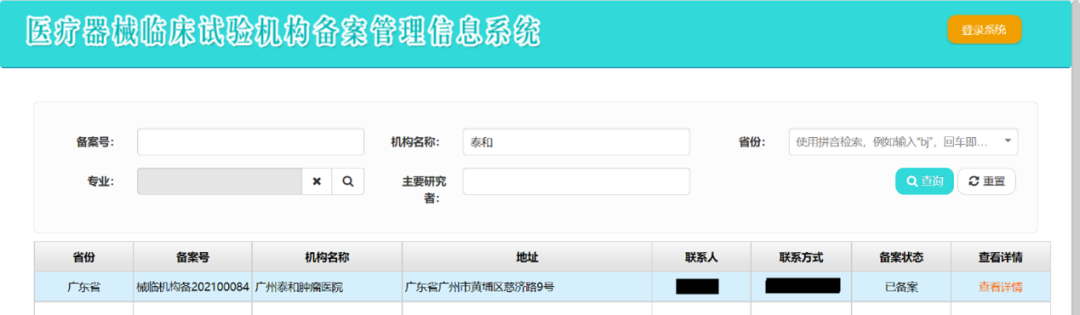
医疗器械临床试验机构备案管理信息系统备案截图
此次我院成功备案的专业有:肿瘤科、医学影像科-放射治疗专业、医学影像科-核磁共振成像诊断专业、医学影像科- CT 诊断专业及医学影像科-核医学专业。我院可开展的医疗器械试验包括:手术、消毒、护理、诊查、治疗、康复器械和诊断试剂等。
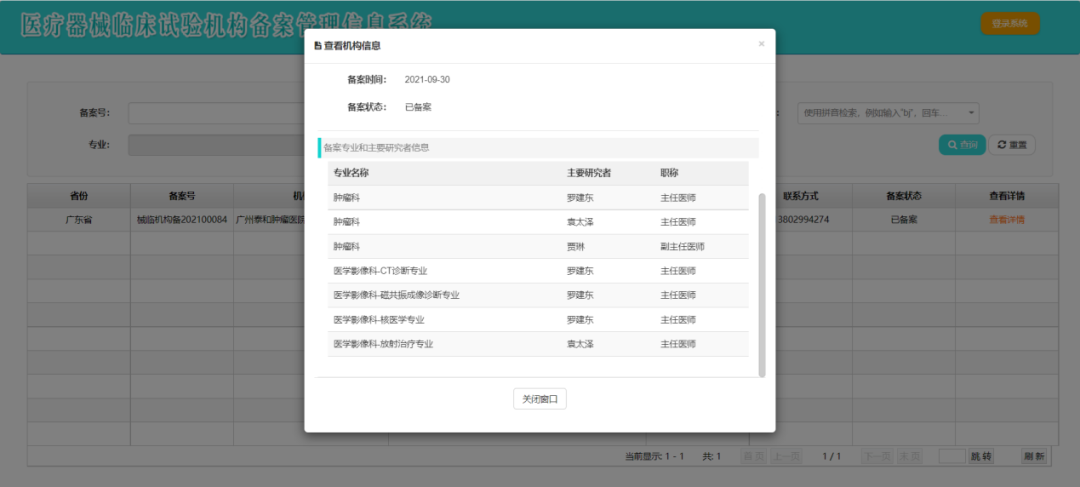
我院成功备案专业的截图
广州泰和肿瘤医院是以美中嘉和集团为运营平台,并在美国德州大学 MD 安德森癌症中心支持指导下建设的三级肿瘤专科医院。目前医院已设置了完整的癌症综合诊疗及辅助治疗科室,亦配备多台直线加速器及 PET/CT 等高端医疗设备。医院同时亦将是粤港澳大湾区首家提供质子治疗的医疗机构。
根据国家药品监督管理局和国家卫健委相关文件法规,医疗器械 (包括体外诊断试剂) 的临床试验只能在具备相应条件且按照规定完成了备案的医疗器械临床试验机构开展。我院于 2020 年初开始启动医疗器械临床试验机构的筹建工作,先后组织人员进行机构资料准备、伦理制度建设、相关人员的专业培训、以及各类标准操作流程的撰写。在此过程中特别感谢广东省药学会组织了全院临床骨干人员进行药物和器械临床试验管理规范的培训。

我院于 2020 年 11 月与广东省药学会联合举办的“药物、器械临床试验法规、技术与实施”培训班的合影
重大意义医疗器械临床试验机构的备案对于我院开展先进医疗设备的临床评价和临床应用具有重大意义。我院计划首批开展 ProBeam 质子治疗系统和多模式引导立体定向与旋转调强一体化放射治疗系统 (TaiChiB 太极) 的临床试验。目前,质子设备的安装工作已基本完成,其系统校准、调试等工作正有条不紊地进行。我院计划于 2022 年 7 月开展质子治疗系统的临床试验工作。
值得一提的是,我院将联合广州泰和医学科技创新中心深入开展肿瘤生态与免疫治疗的转化研究,推动粒子放疗技术的应用和研发,以及发展应用于肿瘤诊疗领域的人工智能产品等前沿技术领域。我院将逐步完善从产品研发到临床验证及临床应用的全链条科技创新服务,打造真正的医疗技术新高地。
我院未来将严格按照相关医疗器械临床试验管理规范的要求,加强对在研项目的质量管控,促进临床试验质量的持续提升。此外,我院将在完成医疗器械临床试验机构备案的基础上,力争明年初完成药物临床试验机构的备案,严格遵守国家相关法律法规,进一步大力建设和管理好我院的临床试验工作。


